Клинические исследования
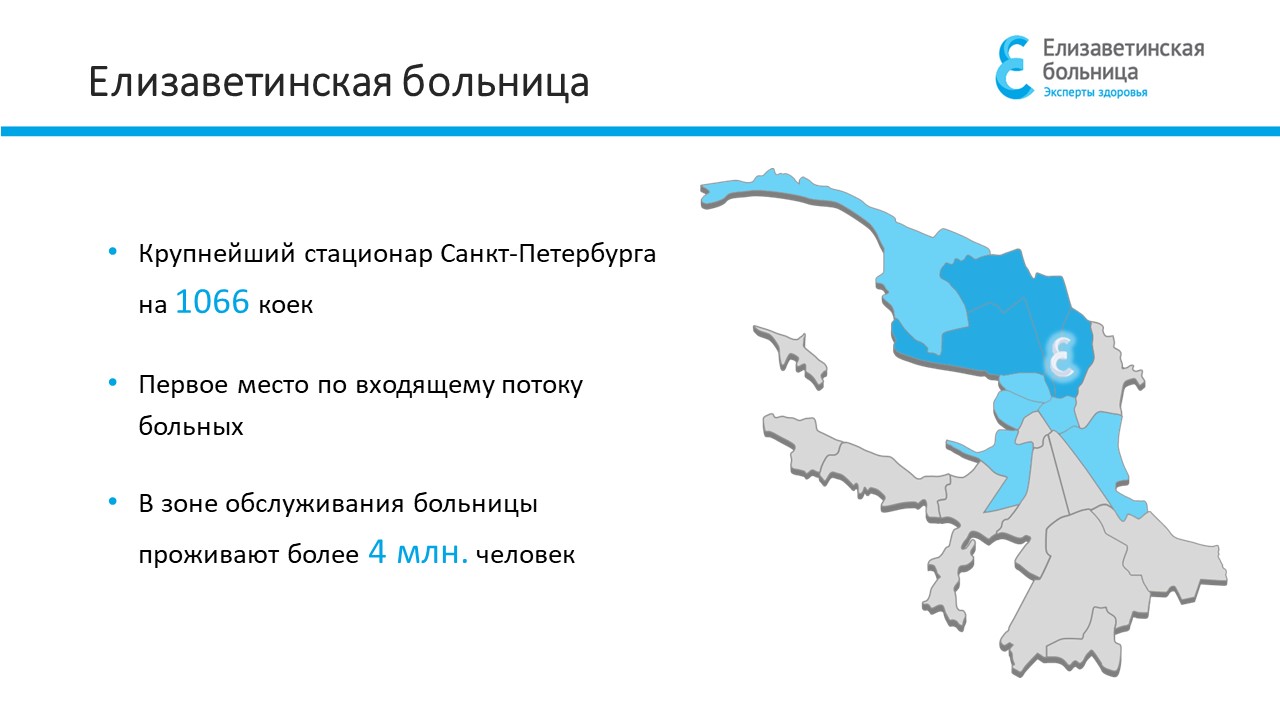
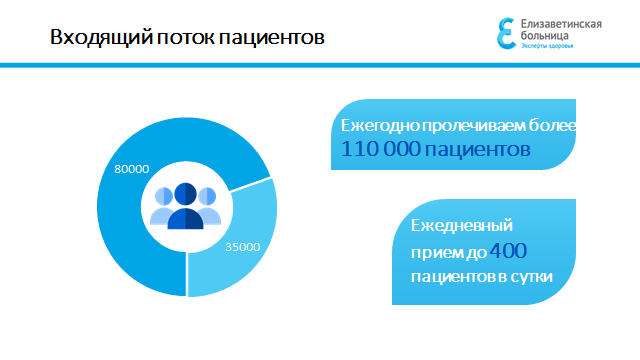
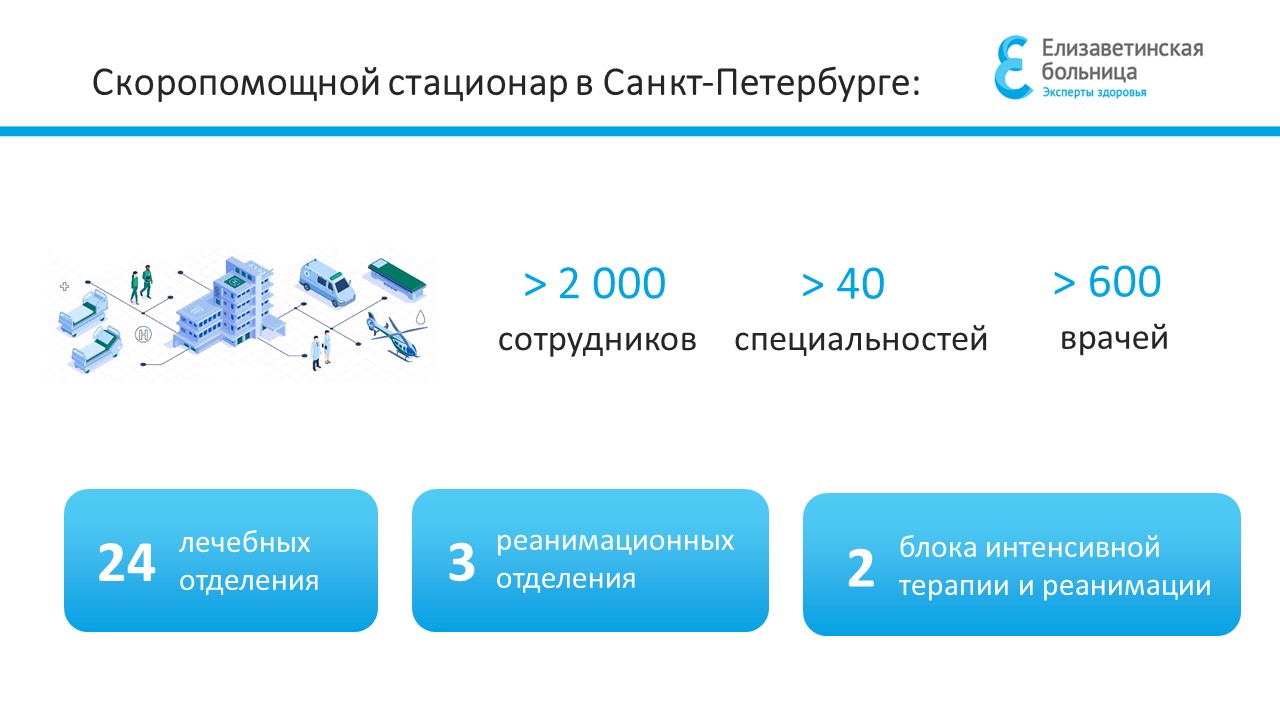
Координационный центр клинических исследований СПб ГБУЗ «Елизаветинская больница» осуществляет планирование, организацию и сопровождение клинических исследований

Основными направлениями деятельности координационного центра являются:
➤ Рассмотрение поступающих заявок на проведение клинических исследований
➤ Заключение договоров, контроль за исполнением обязательств по договорам
➤ Осуществление взаимодействия с заказчиками исследований на всех этапах проведения исследований
➤ Взаимодействие с Локальным этическими комитетом СПб ГБУЗ «Елизаветинская больница» на всех этапах планирования и проведения исследований
➤ Разработка, согласование и внедрение инструкций (операционных процедур) по проведению исследований в СПб ГБУЗ «Елизаветинская больница»

Контактная информация:
📍: г. Санкт-Петербург, ул. Вавиловых 14, литера «А»
👩💼: Королёва Елена Евгеньевна
📞: 8 (812) 246 10 10, доб.2694
❗️Прием обращений осуществляется только с почтовых провайдеров РФ (mail.ru/yandex.ru/rambler.ru и пр.). Обращения с иностранных почтовых сервисов зарегистрированы не будут.❗️

Информация для компаний-спонсоров клинических исследований
В соответствии с Положением о проведении клинических исследований в СПб ГБУЗ «Елизаветинская больница» проведение клинического исследования возможно при наличии следующих документов:
➤ Разрешение Федеральной службы по надзору в сфере здравоохранения на проведение клинических испытаний медицинского изделия
➤ Положительного решения Локального этического комитета
➤ Договора о проведении клинического исследования
Организационно-техническое обеспечение проведения экспертизы Локального этического комитета (далее – ЛЭК) осуществляется на платной основе

Для рассмотрения документов на заседании ЛЭК, необходимо заключить договор на организационно-техническое обеспечение первичной этической экспертизы (далее — договор ЛЭК >>)
График заседаний на 2026 год >>
Для заключения договора ЛЭК необходимо предоставить следующие документы:
➤ Протокол клинического исследования
➤ Брошюра исследователя клинического исследования
➤ Проект договора клинического исследования
➤ Разрешение Федеральной службы по надзору в сфере здравоохранения на проведение клинических испытаний медицинского изделия
Заполненный заказчиком договор ЛЭК и документы для заключения договора ЛЭК направляются на адрес электронной почты centrki@eliz-spb.ru.
Документы на заседание ЛЭК подаются не позднее, чем за 5 (пять) рабочих дней до заседания.
Если документы поданы позже, заявка может быть рассмотрена в ускоренном порядке. В этом случае необходимо заключить договор на ускоренное организационно-техническое обеспечение первичной этической экспертизы (далее — договор ЛЭК ускоренный >>).
Оригиналы подписанных договоров ЛЭК передаются курьерской службой в Координационный центр клинических исследований СПб ГБУЗ «Елизаветинская больница».
ㅤ

Заседание Локального этического комитета СПб ГБУЗ «Елизаветинская больница»
После заключения договора ЛЭК или Договора ЛЭК ускоренного в адрес ЛЭК на электронную почту lek@eliz-spb.ru направляются документы на рассмотрение.
Обращаем Ваше внимание на то, что ВСЕ документы предоставляются в электронном виде на русском языке, а для международных клинических исследований дополнительно на языке страны-заявителя или английском языке.
Список документов, необходимых для рассмотрения заявки на заседании ЛЭК (с указанием версии и даты):
➤ Письмо подачи (скачать образец >>) с датами и номерами версий по установленной Учреждением форме (письмо-подачи подписанное исследователем)
➤ Текущая версия научной биографии исследователя (curriculum vitae) по форме МЗ РФ
➤ Разрешение Федеральной службы по надзору в сфере здравоохранения на проведение клинических испытаний медицинского изделия
➤ Протокол клинического исследования
➤ Форма информационного листка и форма информированного согласия
➤ Брошюру исследователя
➤ Сведения о медицинских организациях, в которых предполагается проведение клинического исследования
➤ Копии договора обязательного страхования, заключенного в соответствии с типовыми правилами обязательного страхования, с указанием предельной численности пациентов, участвующих в клиническом исследовании
➤ Информация о составе лекарственного препарата
➤ Известную информацию, касающуюся безопасности
➤ Образцы рекламной продукции, если применимо
➤ Письменные материалы, которые будут предоставлены субъектам, если применимо
➤ Материалы по электронным, диагностическим и другим устройствам, которые будут предоставлены испытуемым, если применимо
➤ Информация о выплатах и компенсациях испытуемым, если применимо
➤ Иные документы по требованию ЛЭК
Документы предоставляются по одному из вариантов (в электронном виде):
➤ В защищенной папке в первом письме
➤ С указанием кода доступа/пароля во втором письме
➤ По е-mail: lek@eliz-spb.ru, а также на электронный адрес ответственного секретаря, который предоставляется по запросу
⠀
Правовой основой выполнения клинических исследований в СПб ГБУЗ «Елизаветинская больница» являются:
➤ Конституция Российской Федерации
➤ Гражданский Кодекс Российской Федерации
➤ Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»
➤ Федеральный закон от 21.11.2011 № 323-Ф3 «Об основах охраны здоровья граждан в Российской Федерации»
➤ ГОСТ Р 52379-2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика
➤ Руководство по надлежащей клинической практике Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком (ICH GCP Guidelines)
➤ ГОСТ Р ИСО 14155-2014. Национальный стандарт Российской Федерации. Клинические исследования. Надлежащая клиническая практика
➤ Постановление Правительства Российской Федерации от 13.09.2010 № 714 «Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата»
➤ Приказ Минздрава России от 01.04.2016 № 200н «Об утверждении правил надлежащей клинической практики»